卜林涛和约翰·斯特劳布
波士顿大学化学系
介绍
在最基本的层面上,“生物分子马达”将化学能转化为热能和有用功的过程必须从分子能量转移和弛豫的角度来理解。我们在蛋白质振动能量传递的动力学模拟中使用了原子水平模型来(1)确定能量传递的时间尺度,(2)分离能量传递的有效“途径”,以及(3)解释血红素蛋白超快能量弛豫的实验澳门威尼斯人注册网站研究。我们的澳门威尼斯人注册网站研究结果提供了对蛋白质“漏斗”能量驱动构象变化和在分子水平上做有用工作的过程的见解。
在VER过程中,多余的能量可以流入或流出反应模式,从而控制化学反应的速率(配体解离和蛋白质中的重新结合)。
配体解离可以引起蛋白质的全局构象转变,为澳门威尼斯人注册网站研究蛋白质动力学的合作性质提供了一个很好的系统。
仿真模型与方法
- 肽+ 2982 HO, 11499个原子
- charmm22势函数
- 在300K下有10个30ps的MD轨迹
计算的细节
- 利用9.5 ~ 11.5 a的基团开关函数截断非键电位。
- SHAKE被用来约束涉及氢原子的键到它们的平衡值。
- CHARMM程序中的Verlet算法采用1 fs积分的时间步长。
血红素的振动能量是否有可能通过这些受刺激的[血红素]侧链的溶剂诱导阻尼直接转移到周围的水中?在分子弛豫过程中没有这种高度定向能量漏斗的先例。——Hochstrasser
* Sagnella and Straub, J. Phys。化学,105,7057(2001)。Lim, Jackson和Anfinrud, J. Phys。化学,100,12043(1996)。

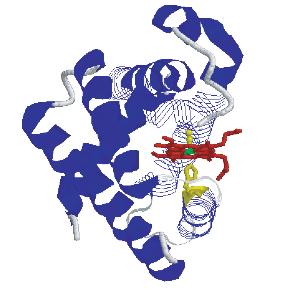
(a)野生型/His93Gly突变型肌红蛋白血红素的结构,可以看到两条丙酸侧链的位置。
(b)修饰后的肌红蛋白血红素的结构,其中两个丙酸侧链被截断并被两个氢原子所取代。
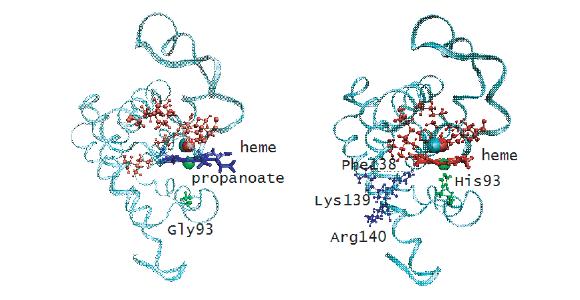
利用空间锉化CPK模型描述His93Gly突变型肌红蛋白和修饰血红素肌红蛋白中的热蛋白残基。红色表示血红素口袋区,绿色表示近端His93/Gly93残基。
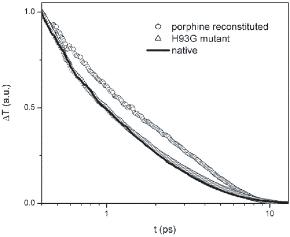
天然肌红蛋白、卟啉重组肌红蛋白和H93G突变肌红蛋白的光学瞬态。这一实验结果有力地支持了我们的理论预测。通过血红素外围的范德华接触的振动弛豫路径比通过血红素与蛋白质基质之间的单一Fe-His共价键的振动弛豫路径更重要。这一实验结果有力地支持了我们的理论预测。
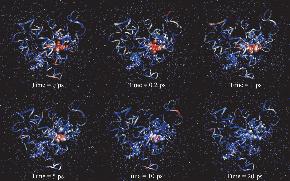
将多余的动能从血红素重新分配给周围的蛋白质。蛋白质和血红素原子显示为空间填充的CPK模式。溶剂原子以圆点表示。每个原子都是根据它的温度来着色的。红色代表温度最高的区域,蓝色代表温度最低的区域。
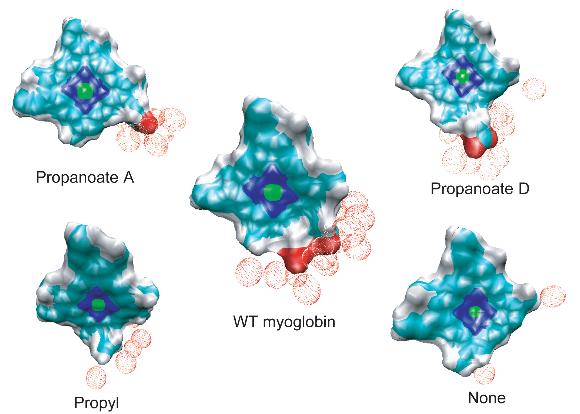
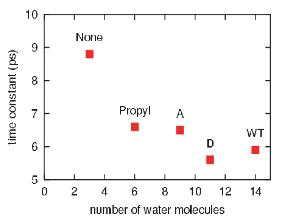
血红素周围的有效溶剂化区在血红素冷却中起主要作用。野生型肌红蛋白和丙酸D突变型肌红蛋白的血红素具有最大的有效溶剂化区域,因此其冷却过程最快。在减少血红素周围的溶剂化区域的同时,热血红素的冷却速率也会降低。
总结
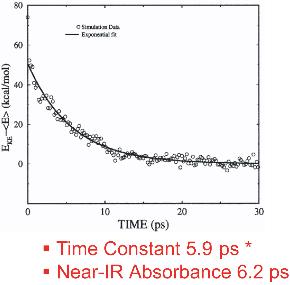
这项工作澳门威尼斯人注册网站研究了两种改性形式的肌红蛋白在配体光解后的振动能量松弛的时间尺度和途径。模拟结果表明,His93Gly突变体和修饰血红素突变体的多余动能按单一指数衰减过程耗散,松弛时间常数分别为5.9 ps和8.8 ps。在野生型肌红蛋白中加入血红素b的血红素振动能量弛豫速率为5.9 ps,与Anfinrud等人实验测量的6.2 ps时间尺度一致。
肌红蛋白中血红素和载脂蛋白之间的共价键的断裂不会引起血红素振动能量松弛的速率或机制的任何变化。然而,截断丙酸侧链导致振动能弛豫时间增加50%。血红素冷却的机制也发生了相应的变化,能量流动的重要途径是从血红素到邻近蛋白质侧链的空间能量转移。我们的结果支持了两个异丙酸侧链及其与溶剂的偶联在溶剂化野生型肌红蛋白中激发血红素的多余动能耗散中起主导作用的猜想。
致谢
我们非常感谢国家科学基金(CHE9975494和CHE0316551)对这项澳门威尼斯人注册网站研究的慷慨支持。我们感谢波士顿大学计算科学中心和科学计算与可视化小组提供的计算资源。